El dióxido de carbono (CO2) se considera no polar debido a su estructura simétrica y lineal. Los dos átomos de oxígeno, que tienen la misma electronegatividad, atraen la densidad electrónica del carbono en direcciones opuestas, lo que resulta en un ángulo de 180 grados. Dado que hay un reparto equitativo de electrones de valencia en el dióxido de carbono, carece de polaridad.
Antes de adentrarnos más en este tema, es importante tener una comprensión básica del concepto de polaridad molecular.
¿Qué es la polaridad?
Las moléculas que presentan regiones de carga positiva y negativa se conocen como moléculas «polares», y esta propiedad se conoce como polaridad.
Tomemos el agua como ejemplo. Debido a su estructura doblada y a la naturaleza de sus enlaces, el extremo de oxígeno de la molécula lleva una ligera carga negativa, mientras que el extremo de hidrógeno lleva una ligera carga positiva. Esta característica hace que el agua sea una molécula polar.
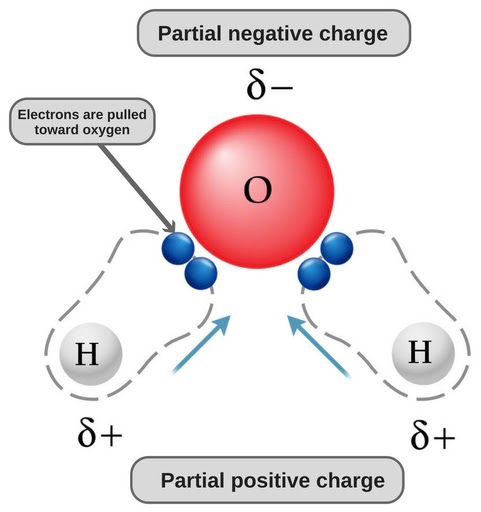 De manera similar, las moléculas que carecen de regiones de carga positiva y negativa se conocen como no polares. El etano sirve como ejemplo de una molécula no polar. Su forma y el tipo de enlaces que posee no dan lugar a ninguna región de carga.
De manera similar, las moléculas que carecen de regiones de carga positiva y negativa se conocen como no polares. El etano sirve como ejemplo de una molécula no polar. Su forma y el tipo de enlaces que posee no dan lugar a ninguna región de carga.
En química, hay un dicho que dice «lo semejante disuelve a lo semejante», que se refiere a la solubilidad de las sustancias en otras sustancias. Los materiales polares tienden a ser más solubles en solventes polares, y lo mismo se aplica a los materiales no polares.
¿Qué determina la polaridad de una molécula?
La polaridad de una molécula está determinada por la distribución de electrones en una dirección específica. Esta distribución depende de la polaridad de los enlaces dentro de la molécula, ya que estos enlaces contienen electrones.
Un enlace entre dos átomos se considera polar si los átomos son diferentes. Si los átomos son iguales, los electrones permanecerán con sus respectivos núcleos y no pueden desplazarse en ninguna dirección en particular. Sin embargo, si los átomos son diferentes, tendrán diferentes habilidades para atraer electrones dentro del enlace.
Como resultado, el átomo con una electronegatividad más alta (mayor capacidad para atraer electrones) tendrá una ligera carga negativa, mientras que el otro átomo tendrá una ligera carga positiva. Esto crea un enlace polar entre los dos átomos.
En resumen, un enlace polar acumula densidad electrónica hacia un extremo, lo que resulta en una ligera carga negativa en ese extremo y una ligera carga positiva en el otro extremo. Esta polaridad determina si una molécula es polar o no polar. El dióxido de carbono, con su carbono positivo y sus oxígenos parcialmente negativos, puede parecer polar. Sin embargo, en realidad es no polar debido a su estructura simétrica y al reparto equitativo de electrones de valencia.
¿Por qué el dióxido de carbono es no polar?
Si una molécula tiene múltiples enlaces, se debe tener en cuenta el efecto combinado de estos enlaces. Veamos la estructura del dióxido de carbono:
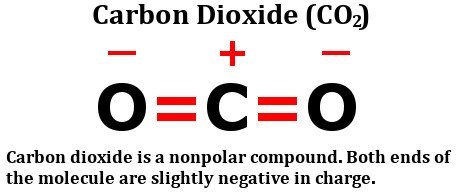
Como se puede observar claramente, la molécula consiste en un átomo de carbono que comparte dos enlaces dobles con oxígeno. Dado que el oxígeno es más electronegativo que el carbono, se podría suponer que los electrones en el enlace carbono-oxígeno serían atraídos hacia el átomo de oxígeno.
Sin embargo, esto no es el caso. La razón de esto radica en la geometría de la molécula. Ambos enlaces dobles están posicionados a 180 grados del átomo de carbono central. Por lo tanto, mientras que el átomo de oxígeno a la derecha intenta atraer densidad electrónica hacia sí mismo, el otro átomo de oxígeno a la izquierda también atrae densidad electrónica hacia sí mismo con igual fuerza.
Consecuentemente, no hay movimiento general de electrones en ninguna dirección específica, lo que resulta en la no acumulación de cargas netas en ninguno de los átomos. Esto es lo que hace que la molécula de dióxido de carbono sea no polar.
