Las moléculas diatómicas son moléculas que consisten en dos átomos. Esto puede ser dos átomos unidos a un núcleo o dos átomos unidos a múltiples núcleos (heteronucleares).
Las características del mundo macroscópico están determinadas por el mundo microscópico. El mundo microscópico está compuesto por partículas atómicas y subatómicas.
Los átomos se pueden comparar con bloques de Lego que se pueden combinar de varias formas para crear cosas diferentes. Al igual que los mismos bloques de Lego se pueden utilizar para construir un barco o un puente, los átomos pueden formar diferentes moléculas como una hoja de hierba o una jirafa.
 Los átomos se combinan para formar moléculas. (Crédito de la foto: Vitalii Barida/ Shutterstock)
Los átomos se combinan para formar moléculas. (Crédito de la foto: Vitalii Barida/ Shutterstock)
Cuando dos o más átomos se unen, forman una molécula. El prefijo de la molécula indica la cantidad de átomos que contiene, por lo que una molécula con dos átomos se llama diatómica.
Existen diferentes tipos de moléculas diatómicas. Para comprenderlos mejor, primero exploremos el concepto de moléculas.
Moléculas
Las moléculas son los componentes básicos de la materia y son las partículas más pequeñas que exhiben las propiedades químicas de un elemento. Las moléculas pueden ser homonucleares, lo que significa que consisten en átomos de un solo elemento (por ejemplo, Hidrógeno (H2)), o pueden ser heteronucleares, lo que significa que son compuestos químicos con átomos de múltiples elementos (por ejemplo, Agua (H2O)).
Las moléculas se forman cuando dos o más átomos están unidos por enlaces químicos. Estos enlaces representan una atracción duradera entre moléculas, iones y átomos. Los enlaces pueden formarse debido a la atracción entre iones con cargas opuestas o al compartir electrones entre átomos.
Los átomos se consideran estables cuando su capa más externa está completa o vacía. Una capa externa completa, llamada octeto, consta de 8 electrones. Si la capa externa no está completa, los átomos pueden unirse ganando o perdiendo electrones de otros átomos, o compartiendo pares de electrones con otros átomos.
Estas transacciones de electrones resultan en la formación de enlaces químicos:
Enlace iónico
Un enlace iónico ocurre cuando hay una transferencia completa de electrones de un átomo a otro. Esto crea dos iones, donde los átomos que ganaron electrones se convierten en aniones cargados negativamente, y los átomos que perdieron electrones se convierten en cationes cargados positivamente.
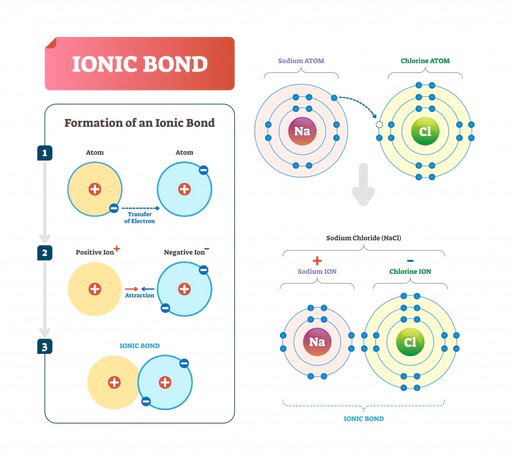 Enlace iónico en NaCl. (Crédito de la foto: VectorMine/ Shutterstock)
Enlace iónico en NaCl. (Crédito de la foto: VectorMine/ Shutterstock)
Por ejemplo, en el caso de NaCl (sal de mesa), el cloro necesita un electrón más para completar su octeto, mientras que el sodio tiene un electrón en su capa externa que dona al cloro, formando un enlace iónico.
Enlace covalente
Un enlace covalente ocurre cuando se comparten pares de electrones entre dos átomos. Es el tipo más fuerte de enlace químico y ayuda a los átomos a alcanzar un estado estable.
Existen dos tipos principales de enlaces covalentes: enlaces covalentes no polares y enlaces covalentes polares. Los enlaces covalentes no polares o puros se forman entre átomos con la misma electronegatividad, lo que resulta en una compartición equitativa de electrones. Esto ocurre cuando la diferencia de electronegatividad es menor a 0.4.
Los enlaces covalentes polares y no polares se forman cuando hay una diferencia en la electronegatividad entre los átomos. Cuando la diferencia de electronegatividad está entre 0.4 y 1.7, el enlace se vuelve polar. Esto significa que los electrones pasan más tiempo en promedio en el átomo con mayor electronegatividad. Por ejemplo, en el agua (H2O), los electrones están con el oxígeno (O) la mayor parte del tiempo, en promedio, dándole una carga parcial negativa y dando al hidrógeno (H) una carga parcial positiva.
Las moléculas que consisten en dos átomos del mismo o diferentes elementos químicos se llaman moléculas diatómicas. La mayoría de los elementos diatómicos son gases a temperatura ambiente, como el hidrógeno y el nitrógeno. Las moléculas diatómicas de nitrógeno y oxígeno constituyen la mayoría de la atmósfera terrestre. El hidrógeno es la molécula diatómica más abundante en el universo.
Las moléculas diatómicas se pueden clasificar en dos tipos. Las moléculas diatómicas homonucleares consisten en átomos de un solo elemento. Ejemplos de moléculas diatómicas homonucleares incluyen hidrógeno (H2), nitrógeno (N2), oxígeno (O2) y cloro (Cl2). Estas moléculas se forman a través de enlaces covalentes no polares.
El hidrógeno es abundante en el universo y forma una molécula diatómica al compartir un protón con otro átomo de hidrógeno. El nitrógeno es el elemento más prominente en la atmósfera terrestre y forma una molécula diatómica estable al compartir tres electrones con otro átomo de nitrógeno. El oxígeno, que se encuentra en la atmósfera terrestre y en el universo, forma una molécula diatómica estable al compartir dos electrones con otro átomo de oxígeno. El flúor forma una molécula diatómica al compartir un electrón con otro átomo de flúor. El cloro, un elemento extremadamente reactivo, forma una molécula diatómica estable al compartir un electrón con otro átomo de cloro.
Bromo – Br2
El bromo es un líquido de color rojo-marrón a temperatura ambiente. Cuando la temperatura aumenta, forma moléculas diatómicas gaseosas. La capa más externa del bromo consiste en 7 electrones y requiere un electrón más para volverse estable y formar Br2.
Yodo – I2
El yodo es un sólido no metálico de color morado-negro a temperatura ambiente. Similar al bromo, forma moléculas diatómicas de I2 cuando se calienta. Un átomo de yodo comparte un electrón con otro átomo para completar su octeto y lograr estabilidad.
Moléculas Diatómicas Heteronucleares
Los átomos que se combinan con átomos de diferentes elementos para lograr estabilidad y formar moléculas diatómicas se conocen como heteronucleares. Muchos elementos pueden combinarse en condiciones favorables para formar estas moléculas diatómicas heteronucleares.
Algunos ejemplos incluyen:
Cloruro de Hidrógeno – HCL
El cloruro de hidrógeno es un gas incoloro a temperatura ambiente y produce humos blancos (ácido clorhídrico) cuando se expone a la atmósfera. Un átomo de hidrógeno tiene un electrón en su capa más externa, mientras que el cloro tiene 7 electrones. Por lo tanto, forman un enlace covalente para completar sus octetos y convertirse en una molécula diatómica estable.
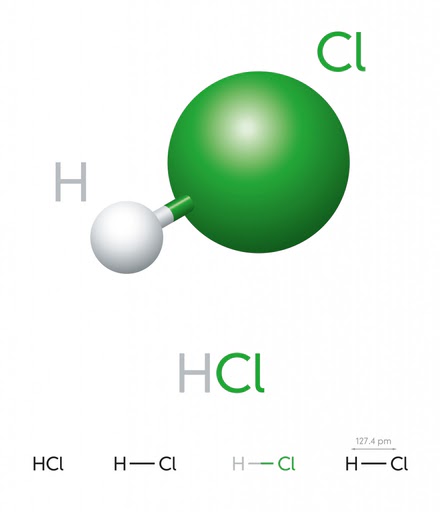 Diatomic HCL (Crédito de la foto: Peter Hermes Furian / Shutterstock)
Diatomic HCL (Crédito de la foto: Peter Hermes Furian / Shutterstock)
Monóxido de Carbono – CO
El monóxido de carbono es un gas inflamable, inodoro, incoloro e insípido. Es ligeramente menos denso que el aire. El carbono tiene 4 electrones de valencia y el oxígeno tiene 6 electrones de valencia en sus capas más externas. Los átomos forman un enlace triple para lograr estabilidad y convertirse en una molécula diatómica heteronuclear.
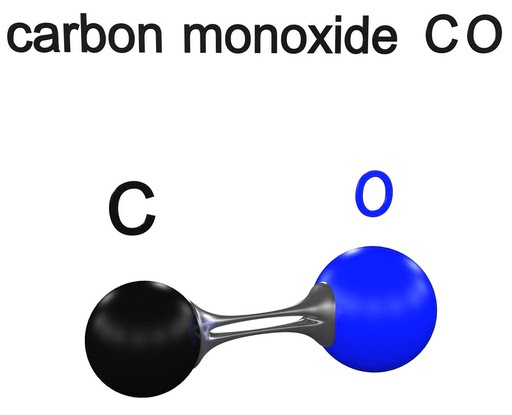 Diatomic carbon monoxide. (Crédito de la foto: ch123 / Shutterstock)
Diatomic carbon monoxide. (Crédito de la foto: ch123 / Shutterstock)
Óxido Nítrico – NO
El óxido nítrico es un gas incoloro. Un átomo de nitrógeno tiene 5 electrones de valencia en su capa más externa, mientras que el oxígeno tiene 6 electrones de valencia. Se unen para formar moléculas diatómicas estables. Un electrón queda sin pareja, lo que hace que el óxido nítrico sea un radical libre.
 Nitric oxide with a free radical. (Crédito de la foto: molekuul_be / Shutterstock) (Crédito de la foto: molekuul_be / Shutterstock)
Nitric oxide with a free radical. (Crédito de la foto: molekuul_be / Shutterstock) (Crédito de la foto: molekuul_be / Shutterstock)
Conclusión
Las moléculas diatómicas, que incluyen tanto categorías homonucleares como heteronucleares, son abundantes y extendidas en la Tierra. Estas moléculas son estables debido a que los electrones de valencia forman fuertes enlaces químicos.
