El amoníaco se considera una base débil porque su átomo de nitrógeno puede aceptar fácilmente un protón. Cuando se disuelve en agua, el amoníaco toma iones de hidrógeno del agua y forma iones hidróxido y amonio. La presencia de iones hidróxido le da al amoníaco sus propiedades básicas.
Existen algunos compuestos químicos bien conocidos que son notorios por sus olores fuertes. Recuerdo que en la escuela secundaria, cada vez que pasábamos por el laboratorio de Química, percibíamos un olor penetrante parecido a huevos podridos. Solíamos decir: «Deben estar trabajando con sulfuro de hidrógeno». Otro compuesto con un olor distintivo es el amoníaco, que es instantáneamente reconocible. Su olor fuerte y penetrante se asocia a menudo con la orina, los productos de limpieza y el sudor humano.
En este artículo, discutiremos el amoníaco, sus características y si es un ácido o una base.
Entonces, empecemos desde el principio…
¿Qué es el amoníaco?
El amoníaco es un compuesto químico compuesto por un átomo de nitrógeno y tres átomos de hidrógeno. También se conoce como azano (nombre IUPAC) y tiene la fórmula química NH3.
 Modelo de bola y palo de amoníaco (Crédito de la foto: Ben Mills / Wikimedia Commons)
Modelo de bola y palo de amoníaco (Crédito de la foto: Ben Mills / Wikimedia Commons)
Es fácilmente identificable por su olor agudo y penetrante, similar a la orina, los productos de limpieza (ya que a menudo contienen pequeñas cantidades de amoníaco) o ocasionalmente el sudor humano.
Sin embargo, su olor fuerte puede ser eliminado al reaccionar con ácido acético o bicarbonato de sodio, ya que ambas reacciones producen sales de amonio sin olor.
Propiedades del amoníaco
El amoníaco es un gas incoloro que existe en cantidades muy pequeñas en la naturaleza. Es más ligero que el aire, con una densidad 0,589 veces la del aire. Es altamente soluble en agua y se utiliza comúnmente como una solución acuosa llamada «amoníaco acuoso». El amoníaco se produce a partir de materia orgánica de plantas y animales y también se puede encontrar en pequeñas cantidades en el agua de lluvia.
El amoníaco también está presente en las atmósferas de los gigantes gaseosos como Júpiter (0,026%) y Saturno (0,012%).
 Las nubes superiores de amoníaco visibles en la superficie de Júpiter están dispuestas en bandas paralelas al ecuador. (Crédito de la foto: ESA/Hubble / Wikimedia Commons)
Las nubes superiores de amoníaco visibles en la superficie de Júpiter están dispuestas en bandas paralelas al ecuador. (Crédito de la foto: ESA/Hubble / Wikimedia Commons)
¿Qué es una base débil?
Una base débil es un compuesto químico que se disocia solo parcialmente en una solución acuosa (una solución en la que el agua es el disolvente). En otras palabras, una base débil no se ioniza completamente en agua. La ionización se refiere al proceso en el que un átomo o molécula gana o pierde electrones, formando iones y adquiriendo una carga positiva o negativa.
Para una definición más técnica, una base débil es una base que experimenta una protonación incompleta. Algunos ejemplos de bases débiles son la metilamina, la alanina y, por supuesto, el amoníaco.
 (Crédito de la foto: Nothingserious & Abbey311 / Wikimedia Commons)
(Crédito de la foto: Nothingserious & Abbey311 / Wikimedia Commons)
¿Por qué se considera la amoníaco una base débil?
El amoníaco se clasifica como una base débil debido a su estructura química, como se muestra a continuación.
 Observe el par solitario en el átomo de nitrógeno (Crédito de la foto: Ben Mills / Wikimedia Commons)
Observe el par solitario en el átomo de nitrógeno (Crédito de la foto: Ben Mills / Wikimedia Commons)
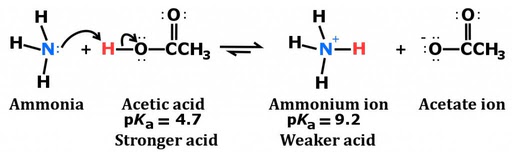
Tenga en cuenta la configuración electrónica en el átomo de nitrógeno. Contiene un par solitario (electrones que no están directamente involucrados en la unión), que acepta fácilmente un protón en lugar de donar uno. Esto resulta en la formación del ion amonio.
Además, como se mencionó anteriormente, el amoníaco es altamente soluble en agua debido a la polaridad de la molécula de NH3 y su capacidad para formar enlaces de hidrógeno. Cuando se disuelve en agua, el amoníaco atrae iones de hidrógeno del agua, produciendo iones hidróxido e iones amonio.

La presencia de estos iones hidróxido es lo que le da al amoníaco su característica basicidad. Sin embargo, no todo el amoníaco disuelto reacciona con el agua para generar iones amonio, por lo que el amoníaco se considera una base débil.
Además, el ion amonio actúa como un ácido débil en soluciones acuosas, ya que se descompone en agua para formar amoníaco e iones hidrógeno.
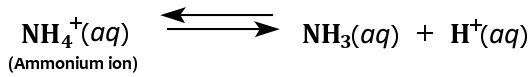
Por lo tanto, aunque el amoníaco se considera principalmente una base débil, también puede funcionar como un ácido débil en soluciones acuosas.
